- 녹십자 코로나19 혈장분획치료제 2상 임상 승인
녹십자에서 개발중인 코로나19 혈장분획치료제 2상 임상시험이 승인됐다.
식품의약품안전처는 국내 개발 코로나19 혈장분획치료제 ‘GC5131’에 대하여 2상 임상시험을 8월 20일 승인하였다고 밝혔다.
이로써 현재 국내에서 코로나19 관련하여 진행 중인 치료제 및 백신의 임상시험은 총 16건(치료제 14건, 백신 2건)이 되었다.
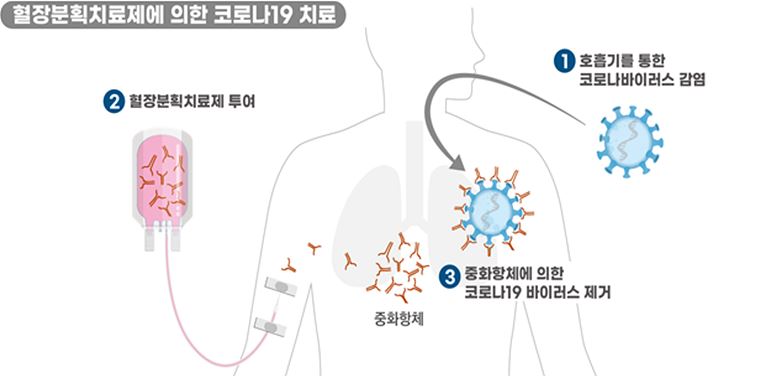
이번에 승인한 ‘GC5131’은 ‘녹십자’에서 코로나19 완치자의 혈장을 이용해 개발 중인 ‘고면역글로불린(Hyper-immune Globulin)’ 성분 의약품으로, 코로나19 환자를 대상으로 안전성과 유효성을 평가하는 2상 임상시험을 진행하게 된다.

➊ 코로나19 완치자로부터 혈장을 채혈 합니다
➋ 코로나19 완치자 혈장을 대량으로 모읍니다.
➌ 혈장 내 다른 성분(알부민, 혈액응고인자 등)과 중화항체가 포함된 면역글로불린을 분리합니다.
➍ 분리된 면역글로불린을 정제‧농축하여 불순물을 제거합니다.
➎ 제제화하여 ‘혈장분획치료제’를 생산합니다.
➏ 품질시험을 실시하고 적합한 제품을 출하합니다.
식약처는 지난 3월부터 혈장분획치료제 개발을 위해 사전상담을 진행해 왔으며, 원료물질인 혈장이 인체에서 유래하고 중화항체를 이용해 질병을 치료하는 동일 원리를 적용한 제품이 예전부터 개발되어 사용되고 있어 임상 1상 시험을 면제하였다고 밝혔다.
참고로 해외에서도 프랑스, 중국, 일본 및 이탈리아에서 혈장분획치료제를 개발 중이며, 현재 6개의 소규모 임상시험이 진행 중에 있다.
BEST 뉴스
-

‘판타지오’82억 불복 속 … 남궁견의 수백억 베팅
차은우의 ‘200억 원대 세금 의혹’이 확산된 지 채 열흘도 안 돼 김선호까지 유사한 논란에 휩싸이면서, 두 배우가 몸담았던 판타지오는 ‘아티스트 리스크’와 ‘세무 리스크’가 한꺼번에 몰려든 형국이 됐다. 이미지 출처=판타지오 누리집 김선호 건은 “가족 법인을 ... -

남궁견의 판타지오, 세무 추징 속 드러난 아이러니
차은우 관련 논란은 판타지오가 과거 부가가치세 환급과 관련해 82억원 규모의 세금을 다시 납부하라는 처분을 받으면서 시작됐다. 회사는 해당 추징 처분에 대해 과세적부심(과세전적부심사)을 청구했으나 결과는 달라지지 않은 것으로 전해졌다. 판타지오 사옥 출처=SNS ... -
![[단독] 승무원 스타벅스 “민폐 논란”의 진실은?](/data/news/202602/news_1770710766.1.jpg)
[단독] 승무원 스타벅스 “민폐 논란”의 진실은?
광화문 일대 스타벅스 매장을 둘러싼 ‘승무원 민폐 논란’이 거세다. 기사의 이해를 돕기위한 AI 생성 이미지입니다 대형 가방과 서류가 매장 곳곳에 놓인 사진과 영상이 확산되자, 기사 제목과 댓글에는 곧바로 '아시아나항공 승무원’, ‘직원 민폐’라는 표현이 따... -
![[단독] 육군훈련소, 카투사 훈련병 특혜 논란...성폭력 혐의자 경징계 논란](/data/news/202602/news_1770106386.1.jpg)
[단독] 육군훈련소, 카투사 훈련병 특혜 논란...성폭력 혐의자 경징계 논란
육군훈련소에서 유명 기업인의 자녀가 훈련병 신분으로 성폭력 혐의에 연루됐다. 육군훈련소는 이와 같은 사실을 확인하고도 상대적으로 가벼운 징계에 그쳐 논란이 불거질 전망이다. 카투사 공개 선발 현장 사진=연합뉴스 3일 위메이크뉴스가 군 안팎을 종합... -
![[단독] 성폭력 피해자는 2기수 유급 vs. 성폭력 가해자는 1기수 유급](/data/news/202602/news_1770106813.1.jpg)
[단독] 성폭력 피해자는 2기수 유급 vs. 성폭력 가해자는 1기수 유급
육군훈련소 입영식 사진=연합뉴스 육군훈련소가 ‘기업인 자녀 봐주기’ 논란에 휘말린 가운데, 성폭력 사태를 둘러싼 가해자와 피해자의 징계 수준이 적절했느냐는 지적도 나온다. 통상 징계가 더 강력한 성폭력 가해 혐의자보다, 커닝 등에 연루된 훈련병에게 보다 가혹한 ... -
![[단독] 초3 일기장에 ‘죽음’…거창 사건, 무엇이 아이를 벼랑 끝으로 몰았나](/data/news/202602/news_1771830924.1.jpg)
[단독] 초3 일기장에 ‘죽음’…거창 사건, 무엇이 아이를 벼랑 끝으로 몰았나
온라인 커뮤니티 올라온 한 초등학생 아버지의 글이 수천 건의 추천과 댓글을 받으며 확산되고 있다. 국민동의청원으로까지 이어진 이번 사안은 단순한 학교폭력 논란을 넘어, 학교·교육청·경찰 대응의 적절성을 둘러싼 구조적 문제로 번지는 양상이다. ...


![[단독] “주인 죽었다”는 부고장에 거짓말까지 …](/data/news/202602/news_1770709987.1.jpg)



















