현재 국내에서 코로나19 관련 진행 중인 임상시험은 총 12건(치료제 10건, 백신 2건)으로 지난 6월 26일 식약처 발표 이후 2건의 임상시험이 추가로 승인되었으며, 5건의 임상시험이 종료되었다.
식약처에 따르면 추가로 승인된 2건은 약물 재창출을 통해 이미 허가된 카모스타트 성분 의약품을 이용하여 개발 중인 CG-CAM20(크리스탈지노믹스) 및 DWJ1248정(대웅제약)이다.
카모스타트는 만성 췌장염 및 역류성 식도염 치료를 위해 사용하는 의약품으로, 세포 단계 시험에서 코로나19 바이러스의 활성을 억제하였고, 바이러스가 감염된 마우스(쥐)에서 생존율 개선 효과를 나타냈다.
참고로, 미국, 영국, 독일 등 5개국에서 카모스타트를 이용한 임상시험이 진행되고 있다.
종료된 5건의 임상시험은 렘데시비르 3건 및 옥시크로린정·칼레트라정, 할록신정 각 1건이다.
렘데시비르는 계획대로 임상시험이 완료되었으며, 옥시크로린정(히드록시클로르퀸)·칼레트라정 비교임상 및 할록신정(히드록시클로르퀸) 임상의 경우, 히드록시클로로퀸의 코로나19 관련 치료적 유익성이 인정되지 않는다는 해외 연구 결과 등에 따라 종료되었다.
백신은 지난 발표와 같이 2건 모두 초기 단계(1상~2상)에 있으며, 이중 국내개발 백신으로는 GX-19(1/2상, 제넥신)이 있다.
현재 임상시험 계획을 심사 중인 코로나19 치료제·백신은 5개이며, 신청을 위해 사전상담이 진행 중인 의약품은 33개가 있다.
심사 중인 5개 제품은 모두 국내 개발 치료제로, 신약 항체치료제가 1개, 약물재창출 치료제가 4개다.
사전상담은 혈장분획치료제 등 치료제 23개 제품, 백신 10개 제품이 진행 중에 있으며, 지역적으로는 국내개발이 27개로 국외개발보다 많다.
이중 혈장분획치료제 등 일부 제품은 조만간 임상시험 승인을 신청할 것으로 예상된다.
최근 국내외에서 공개되고 있는 칼레트라의 치료정보와 관련하여, 영국 및 국제보건기구(WHO) 임상시험 자료를 분석한 결과, 코로나19 입원 환자의 사망률 개선에 대한 효과 부족으로, ‘칼레트라’에 대한 임상시험 중단을 각각 발표하였다.
국내에서는 칼레트라와 히드록시클로르퀸을 비교하는 1건의 연구자 임상시험이 승인되었으나, 히드록시클로르퀸의 치료적 유익성이 인정되지 않는 이유로 종료되었다.
영국과 WHO에서는 칼레트라에 대하여 사망률 개선을 목표로 계획한 임상시험에서 개선 효과가 부족하다고 판단한 것으로, 향후 지속적으로 국외 관련 정보를 수집 관찰해 나갈 예정이다.
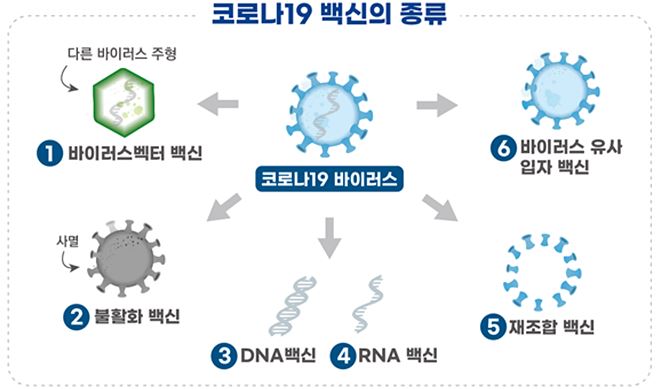
현재 전 세계적으로 개발되고 있는 코로나19 백신의 종류는 바이러스벡터 백신, 불활화 백신, DNA 백신, RNA 백신, 재조합 백신, 바이러스 유사입자 백신이 있다.
BEST 뉴스
-
![[단독] ‘일광 노르웨이숲 오션포레’ “최고급 단지라더니 하수단지?”](/data/news/202512/news_1766562933.1.jpeg)
[단독] ‘일광 노르웨이숲 오션포레’ “최고급 단지라더니 하수단지?”
부산 기장군 일광읍에서 유림종합건설이 시행한 신축 아파트 ‘일광 노르웨이숲 오션포레’를 둘러싼 하수처리시설 논란이 시간이 흐를수록 단순한 분양자의 개별 불만을 넘어서는 국면으로 발전하고 있다. 이미지 출처=일광 노르웨이숲 오션포레 누리집 ... -

호카 국내 총판 조이윅스 조대표… 폐건물로 불러 하청업체에 ‘무차별 폭행’
유명 러닝화 브랜드 호카의 국내 총판 대표 조모씨가 하청업체 관계자들을 서울 성수동의 폐건물로 불러 무차별 폭행을 가했다는 주장이 제기됐다. 당시 상황이 담긴 녹취와 피해자 진술이 공개되면서 파장이 확산되고 있다. 이미지 출처=SNS 갈무리 ... -

유동성 압박 상황에… 바이오에 1조 쏟는 롯데그룹
롯데그룹이 최근 수년간 이어진 실적 둔화와 유동성 부담 논란 속에서도 바이오 사업에 누적 1조원 이상을 투입하며 정면 돌파에 나서고 있다. 롯데 바이로직스 송도 캠퍼스 (사진 출처 =롯데 바이로직스 누리집) 롯데바이오로직스는 최근 2772억원 규모의 유상증자를 결의... -
![[단독] 얼굴에도 발랐던 존슨앤드존슨 파우더…암 유발 인정, 970억 배상](/data/news/202512/news_1766317961.1.jpeg)
[단독] 얼굴에도 발랐던 존슨앤드존슨 파우더…암 유발 인정, 970억 배상
미국 배심원단이 존슨앤드존슨 베이비파우더 사용으로 암이 발생했다는 피해 주장을 받아들여 거액의 배상 평결을 내렸다. 존슨앤존스 탈크 파우다 (사진출처=로이터 ) 미국 미네소타주 배심원단은 2025년 12월 19일(현지시간), 어린 시... -
![[단독] 예고도 없이 막힌 스타얼라이언스 항공권 발권…아시아나항공에 비난 폭주](/data/news/202512/news_1766360985.1.jpg)
[단독] 예고도 없이 막힌 스타얼라이언스 항공권 발권…아시아나항공에 비난 폭주
스타얼라이언스 [아시아나 제공. 연합뉴스] 아시아나항공 마일리지로 예매가 가능했던 스타얼라이언스 항공편 예매가 불가능한 상황이 터졌다. 대한항공과 합병을 앞두고 있어서다. 아시아나항공 고객들은 사전 고지도 없이 갑자기 마일리지 사용을 막았다며 불만을 터... -

대출 안 했는데 대출 알림… “교보증권 사태” 금융 신뢰 흔들다
대출을 받은 적이 없는 금융소비자들에게 ‘교보증권 신규 대출이 실행됐다’는 알림이 발송되는 일이 발생했다. 이미지 출처=교보증권 누리집 일부 이용자들은 교보증권 계좌조차 보유하지 않은 상태에서 해당 알림을 받아 명의도용이나 개인정보 유출을 의심하며 ...








![[단독] “묻지도 않고 예약 취소”…오버부킹한 스위스항공의 ‘일방통행’](/data/news/202601/news_1768351675.1.jpg)








![[이상헌의 성공창업] 2025년 소상공인·자영업 창업시장 결산과 2026년 전망](/data/news/202601/news_1767251484.1.jpg)



